febrero de 2012
número 4LA TEORÍA ATÓMICA Y EL MÉTODO CIENTÍFICO (PARTE II)
En el número anterior comenzamos el estudio de la evolución de los modelos atómicos a la luz de los nuevos descubrimientos. Así, en la parte I se describió el “nacimiento” del concepto de átomo en el seno de la Grecia clásica y posteriormente se presentaron los primeros modelos atómicos de la química moderna, debidos a Dalton, Thomson y Rutherford.Ver artículo
José Antonio Montiel Tosso
Profesor del Departamento de Física y Química
A pesar de que la física de finales del siglo XIX se consideraba una ciencia prácticamente “acabada”, es decir, una disciplina que iba reservar a la humanidad muy pocas sorpresas y cuya aportación al conocimiento había concluido. Los científicos pensaban en las posibilidades tecnológicas de los principios físicos descubiertos, como la inducción electromagnética y en cómo sacarle el máximo partido a las leyes de la mecánica y el electromagnetismo sin confiar en mayores logros teóricos. Sin embargo, aún existían ciertos fenómenos, como la radiación del cuerpo negro, el efecto fotoeléctrico o los espectros atómicos, que no se podían entender bajo el prisma de los conocimientos que la física había logrado estructurar hasta entonces en el edificio conceptual conocido por física clásica, pero, eso sí, carecían de importancia…o, al menos, así pensaban la mayoría de los científicos en las postrimerías del siglo XIX.
TEORÍA CUÁNTICA
Los cuerpos absorben parte de la radiación incidente sobre ellos y parte la reflejan. Al mismo tiempo, sus átomos emiten cierta radiación desde el interior, parte de la cual sale hacia el exterior de dichos objetos: La radiación térmica es la energía electromagnética emitida por un cuerpo debido a su temperatura. En general, depende también de la composición del cuerpo, excepto en los denominados cuerpos negros, sólidos cuya capacidad de absorción es máxima para la radiación que les llega desde el exterior y, al mismo tiempo, presentan una capacidad de emisión máxima de radiación desde su interior.
Aunque en realidad no existe un cuerpo negro real, podemos tomar como tal una cavidad con un pequeño orificio, cuyas paredes interiores estén pintadas de negro. Es un buen ejemplo, pues absorbe toda la radiación que incide en el agujero (Ver figura 1). Ahora bien, experimentalmente se comprueba que estos cuerpos negros también emiten una determinada radiación, cuya energía por unidad de superficie sólo depende de su temperatura. En definitiva, absorben toda la radiación que incide sobre ellos y la que emiten no es visible a temperaturas ordinarias, por eso se ven negros. Si a un bloque de metal negro se le aumenta la temperatura adquiere un color rojizo oscuro, que luego pasa a rojo vivo, e incluso blanco azulado. Es decir, conforme aumenta la temperatura, la longitud de onda máxima emitida va disminuyendo.
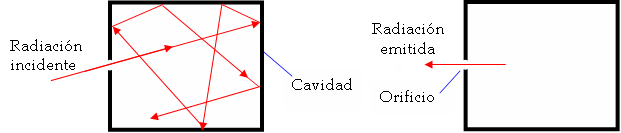
Figura 1. Emisión de un cuerpo negro.
Por otro lado, al estudiar la energía emitida por un cuerpo negro en función de la longitud de onda se comprueba que es muy baja para longitudes de onda pequeñas (zona del ultravioleta), tiene un máximo a longitudes de onda un poco mayores y vuelve a disminuir a longitudes de onda superiores en la banda del infrarrojo (Ver figura 2).
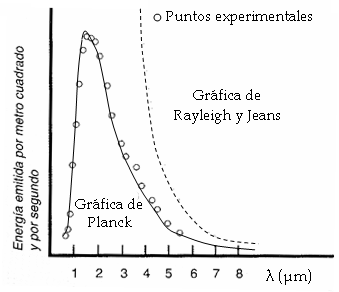
Figura 2. Energía emitida.
Cuando Rayleigh y Jeans intentaron justificar este hecho usando los conceptos de la física clásica (principios del electromagnetismo y mecánica estadística), hallaron que el tipo de gráfica que tendría que cumplir la energía en función de λ sólo se ajusta a la experimental en los valores más altos (línea de puntos) de λ.
Las teorías clásicas para explicar la emisión de radiación de un cuerpo negro predecían que la energía de la radiación aumentaba indefinidamente al disminuir la longitud de onda, mientras que experimentalmente se había comprobado cómo la energía tendía a cero para longitudes de onda muy cortas, como las correspondientes al ultravioleta. Esta discrepancia entre la fórmula de Rayleigh-Jeans y los resultados experimentales se conoce en física con el nombre de “catástrofe ultravioleta”, precisamente por ser en dicha zona del espectro donde se observa la misma.
En dicha tesitura surge en 1900 la figura de Max Planck (figura 3), un físico-matemático que hasta entonces no había aportado nada especial a la comunidad científica pero que se iba a convertir en el creador de una de las dos teorías que revolucionarían la física a principios del siglo XX, transformándola hasta el punto de considerarla como física moderna y estableciendo una nueva visión en el tratamiento de los fenómenos naturales para el mundo subatómico al presentar su hipótesis cuántica. Lógicamente, la otra teoría antes aludida es la relatividad de Einstein, que ha modificado el estudio de la gravitación y de las grandes velocidades y que ha de aplicarse conjuntamente a la de Planck en la interpretación del mundo subatómico.

Figura 3. Planck.
Volviendo a la teoría cuántica, Planck imagina que los átomos se comportan como osciladores armónicos minúsculos cuando absorben o emiten energía. Un oscilador armónico clásico puede ser un objeto de masa m unido a un resorte elástico realizando un movimiento vibratorio armónico simple. La mecánica clásica demuestra que la energía de este oscilador viene dada por la expresión: E = ½ k A(exp 2), donde k es la constante elástica del oscilador y A es la amplitud de la vibración. Por otro lado, si recordamos que para el movimiento armónico simple k = m ω(exp 2), siendo m la masa del oscilador y ω frecuencia angular (pulsación) de las oscilaciones, tendremos para la energía:
E = 2 π(exp 2) m A(exp 2)/T(exp 2)
Y como la frecuencia f es la inversa del período T: E = 2 π(exp 2) m A(exp 2) f(exp 2)
Así pues, la energía emitida por un oscilador armónico es proporcional al cuadrado de la amplitud y al cuadrado de la frecuencia de las vibraciones.
Y aquí llega la genial aportación de Planck. Puesto que observó que la función obtenida para la energía no servía en la interpretación de la radiación del cuerpo negro supuso que la energía emitida o absorbida por los osciladores atómicos era proporcional a su frecuencia de oscilación. Matemáticamente, eliminó el cuadrado en el exponente de la frecuencia, convirtiendo a la energía en una función lineal:
Eo = h f (h es la constante de Planck, 6,625•10-34 J• s).
Así pues, la energía total E emitida o absorbida por una sustancia será un múltiplo de dicha unidad fundamental Eo: E = n h f (n = 1, 2, 3…). Esto también implica que la energía no puede adoptar cualquier valor, sino que está limitada a los múltiplos de dicha unidad fundamental o cuanto. Decimos que la energía está cuantizada. Este es un concepto opuesto al de la mecánica clásica, donde la energía puede tomar un conjunto continuo de valores.
Un modo conveniente de ilustrar el comportamiento de un ente gobernado por este postulado es mediante un diagrama de niveles de energía, como muestra la figura 4. Según el esquema clásico, la energía de un sistema oscilante puede tomar cualquier valor, mientras que en el esquema cuántico, ésta sólo puede tomar una serie de valores definidos, quedando prohibidos todos los valores intermedios entre los valores dibujados.
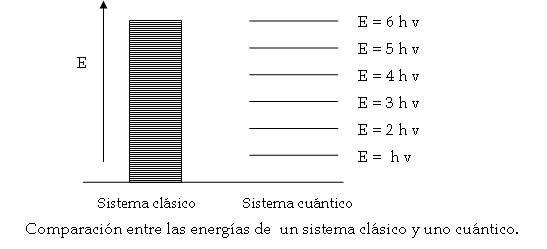
Figura 4. Cuantización
Evidentemente, podría pensarse que un péndulo ordinario describiendo oscilaciones del tipo armónico simple es capaz de poseer valores continuos de energía. Pero, en realidad, esto no es cierto. Sucede que, dada la pequeñez de h, microscópicamente las diferencias entre los estados de energía contiguos son despreciables, de forma que únicamente en los casos en que v sea muy grande y/o E sea tan pequeña que ΔE sea del orden de E, se estará en condiciones de comprobar el postulado de Planck.
Rápidamente se vio que la teoría de Planck, a la que en un principio ni su propio autor le dio demasiada importancia y que la trató más bien como un juego matemático, justificaba perfectamente los resultados de la radiación del cuerpo negro, no sólo en la zona visible o infrarroja, sino en la del ultravioleta, donde había fracasado estrepitosamente la mecánica newtoniana.
EL EFECTO FOTOELÉCTRICO
En cuanto Einstein, un discreto funcionario de la oficina de patentes alemana, tuvo conocimiento de la teoría cuántica, la utilizó para explicar con éxito el efecto fotoeléctrico, lo que le valió el reconocimiento internacional hasta el punto de que le concedieran el premio Nobel.
Hertz descubrió en 1887 que al incidir la luz (visible o UV) sobre muchos metales, éstos desprendían electrones. Es el llamado efecto fotoeléctrico. Posteriormente se comprobó que cada metal posee una frecuencia mínima de la radiación incidente, frecuencia umbral, por debajo de la cual no hay emisión. Además, se vio que a mayor frecuencia incidente mayor es la energía cinética de los electrones emitidos (fotoelectrones) (Ver figura 5).
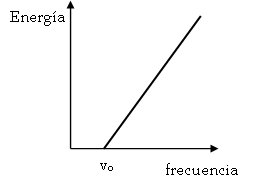
Figura 5. Gráfica del efecto fotoeléctrico.
Según la física clásica el efecto debería darse a cualquier frecuencia, sólo sería necesaria una intensidad suficiente de la radiación que llega al metal. Además, a mayor intensidad incidente tendrían que salir los fotoelectrones con mayor energía cinética. En resumen, los conceptos clásicos sobre la radiación no podían explicar el efecto fotoeléctrico.
Sin embargo, Einstein, en 1905, amplió la teoría cuántica de Planck. Dijo que no sólo los átomos pueden absorber o emitir energía en forma de cuantos o “paquetes de energía”, sino que la propia radiación se propaga también en forma de cuantos. Así, la luz, igual que todas las radiaciones electromagnéticas, está cuantizada en unidades llamadas fotones. De este modo, si la luz que incide sobre una superficie metálica está formada por fotones de frecuencia f y de energía E = h f, cuando un fotón choque contra un electrón lo podrá “arrancar” del metal siempre que su energía (E) sea superior a la energía umbral (W), que es la que mantiene unido al electrón en el metal. Si esto ocurre, la diferencia de energía entre E y W la llevará el electrón en forma de energía cinética, puesto que el fotón es absorbido por él. La expresión matemática es la ecuación fotoeléctrica:
Ec = h f – W
donde Ec es la energía cinética de los fotoelectrones, f es la frecuencia de la luz incidente y W es la energía umbral, también llamada función trabajo, característica de cada metal).
Para la medida experimental de las energías de los fotoelectrones se utiliza el diseño mostrado en la figura 6. Los electrones arrancados al iluminar el cátodo originan una corriente eléctrica de intensidad I al chocar contra el ánodo, que se puede medir con el amperímetro A haciéndola pasar por el circuito inferior. La intensidad es proporcional al número de electrones arrancados.
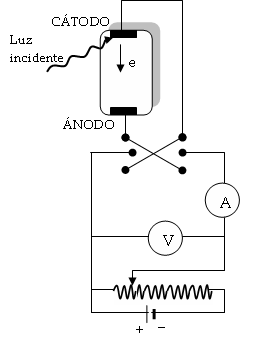
Figura 6. Medida del efecto fotoeléctrico.
Si el ánodo es positivo, atraerá a los electrones. Por lo tanto, para un cierto valor de la diferencia de potencial en el circuito inferior todos los electrones emitidos llegarán al ánodo y conoceremos e valor de I y, con él, dicho número de electrones.
Si el ánodo es negativo, los electrones serán repelidos, y sólo llegarán al mismo los que posean una energía cinética inicial suficiente para vencer el potencial de repulsión aplicado. Para un determinado valor de dicho potencial, denominado potencial de detención o de frenado, VD, ningún electrón llegará al ánodo. Este potencial multiplicado por la carga del electrón nos dará el valor de la energía cinética máxima de los fotoelectrones emitidos:
Ec = e VD.
La importancia de esta interpretación no sólo la podemos apreciar por la concesión del Premio Nobel de Física a Einstein, sino como afirmó Millikan, el efecto fotoeléctrico suministra, independientemente del cuerpo negro, una prueba de la validez de la hipótesis fundamental de la física cuántica: la emisión discontinua de la energía.
UN NUEVO CAMBIO: EL MODELO DE BÖHR
Era evidente que el modelo atómico de Rutherford (1911) no lograba convencer a la comunidad científica a pesar de que todos aplaudían su enorme aportación. Él nos llevó a un concepto de átomo en el que predominaba el espacio vacío, pues la mayor parte del mismo lo integraba la corteza o zona donde se desarrollan las órbitas (circulares) electrónicas, lo cual rompía con la idea anterior de Thomson. Sin embargo, todos sabían que el átomo de Rutherford era físicamente inestable, pues no era posible imaginar una carga girando en torno a otra sin pérdida de energía y mucho menos entender el espectro del átomo de hidrógeno.

Figura 7. Einstein y Planck.
Aunque Einstein (Figura 7) fue el primer científico en observar las enormes posibilidades de la teoría cuántica, debemos al danés Niels Böhr (Figura 8) el mérito de haber sido el primero en utilizarla para elaborar un modelo atómico con el que logró explicar el espectro del hidrógeno en 1913. La idea central del modelo afirma que el átomo de hidrógeno sólo emite o absorbe energía cuando el electrón pasa de una órbita a otra inferior o superior, respectivamente. La energía emitida o absorbida en forma de radiación electromagnética es igual a la diferencia de energía entre ambos estados (órbitas) y viene expresada por la fórmula de Planck:
ΔE = E2 — E1 = h f
siendo E1 y E2 las energías de las órbitas inicial y final entre las que se produce la transición, h la constante de Planck y f la frecuencia de la radiación emitida o absorbida.

Figura 8. Niels Böhr.
De esta manera, el modelo de Böhr constituye el primer modelo cuántico que describe la estructura del átomo de hidrógeno utilizando las nuevas ideas de la física moderna. Incorpora la teoría de Planck con objeto de describir el movimiento del electrón en torno al núcleo de hidrógeno (protón) y logra explicar sus líneas espectrales satisfactoriamente. Se obtienen unos resultados para el radio y la energía de las posibles órbitas que dependen de un número cuántico n, cuyos valores, exclusivamente enteros, a su vez hacen que tanto el radio como la energía estén cuantizados, es decir, sólo les permite adoptar determinadas soluciones.
Böhr fundamentó su modelo en unos sencillos enunciados de los cuales derivó las expresiones de los radios y las energías de las órbitas electrónicas y aplicó la ecuación de Planck para calcular los cambios energéticos asociados a las transiciones o saltos del electrón cuando se mueve desde una órbita a otra.
POSTULADOS DE BÖHR
El modelo de Böhr para el átomo de hidrógeno (1913) se construye a partir de dos postulados:
I) El electrón gira en torno al núcleo, sin perder energía, en órbitas circulares estacionarias que cumplan la condición de que el momento angular del electrón sea un múltiplo entero de la constante de Planck:
m v 2 π R = n h (m v 2 π R es el momento angular)
donde m es la masa del electrón; v, su velocidad; R, el radio de la órbita; h, la constante de Planck y n = 1, 2, 3, 4....
Con este primer enunciado se pretendía eliminar el obstáculo de la inestabilidad física del modelo, que era la circunstancia predicha por el electromagnetismo.
II) El átomo sólo emite o absorbe energía cuando el electrón pasa de una órbita a otra inferior o superior, respectivamente. La energía emitida o absorbida en forma de radiación electromagnética es igual a la diferencia de energía entre ambos estados (órbitas) y viene expresada por la fórmula de Planck:
ΔE = E2 — E1 = h f
siendo E1 y E2 las energías de las órbitas inicial y final entre las que se produce la transición, h la constante de Planck y f la frecuencia de la radiación emitida o absorbida.
Combinando las ecuaciones introducidas por ambos postulados e incluyendo los valores experimentales para la masa y la carga del electrón, ya conocidos con mucha precisión en esa época, se deducen con gran facilidad dos expresiones que nos dan todos los radios y las energías de las posibles órbitas que el electrón tiene permitido describir en torno al protón (Figura 9).
Figura 9. Átomo de hidrógeno.
En definitiva, se obtiene para los radios: R = 0,53 n(exp 2) Angstrom
Y para las energías de las órbitas: E = -13,6/n(esp 2) electrón-voltios
Como decíamos, esas expresiones muestran que tanto el radio de las órbitas como su energía se hallan cuantizados.
Así, para determinar la energía de la transición electrónica desde la órbita de radio R1, obtenido con n = 1, hasta la R2, con n = 2, basta hallar E2 – E1, haciendo previamente n = 1 y n = 2 en la expresión de E.
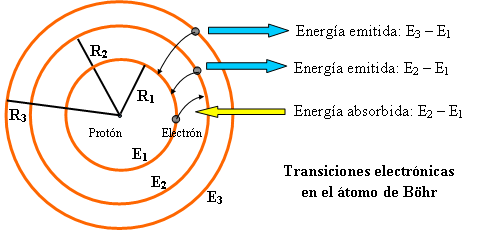
Figura 10. Transiciones electrónicas.
El gran logro del modelo fue obtener un conjunto de valores de niveles de energía cuyas diferencias coincidían exactamente con las energías de las líneas experimentales que aparecían en el espectro de emisión del átomo de hidrógeno. De tal modo que cada una de las posibles transiciones o saltos del electrón de una órbita a otra se podía asociar con una de las líneas espectrales (Ver figura 10). El reconocimiento del mundo científico por la importancia de las aportaciones de Böhr le llegó en el año 1922 con el Premio Nobel de física.
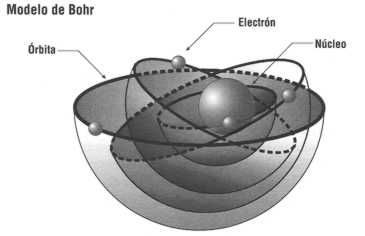
Figura 11. Modelo de Böhr.
(Continúa en el próximo número)
José Antonio Montiel Tosso
Departamento de Física y Química



| ISSN: 1988-9607 | Redacción | www.iesseneca.net |


 Versión imprimir
Versión imprimir